LOS PERÓXIDOS
SEPTIMO
PLAN DE CLASE DE QUIMICA SEGUNDO-PARCIAL SEGUNDO QUIMESTRE
(CONTINGENCIA COVID19)
1. Datos
informativos:
Docente: Lic.
Rocío Bayas V.
Área :Ciencias Naturales
Curso:
Primeros A,B,C,-A- Técnico Asignatura: Química
Unidad: Cuatro
Fecha-SEMANA DE: 27/04/2020 a 01/05/2020
Tema: FORMACIÓN DE
LOS COMPUESTOS BINARIOS
Hidruros y peróxidos
ACTIVIDADES:
•Revisamos
la información sobre hidruros
y peróxidos en las páginas 119 y
120, prestamos
atención a la formación y nomenclatura de cada ejercicio propuesto en el texto.
INFORMACION DEL CONOCIMIENTO
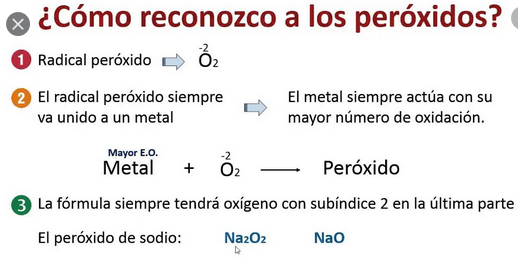
4.13. Función peróxido
Peróxidos
Se definen como un superóxido, ya que contiene mayor cantidad de oxígeno que los óxidos básicos
Peróxidos
Se definen como un superóxido, ya que contiene mayor cantidad de oxígeno que los óxidos básicos
.
Formación: Se forman por la reacción de los óxidos de la primera y segunda familia de los metales con el oxígeno.
Formación: Se forman por la reacción de los óxidos de la primera y segunda familia de los metales con el oxígeno.
Ejemplo: Para formar el peróxido de cadmio se hace reaccionar el óxido de cadmio con el oxígeno y obtenemos el
peróxido de cadmio.
El nombre genérico es la palabra peróxido y el específico el nombre del metal del cual proviene.
Óxido de cadmio + Oxígeno--------àCdO2
Obtención de un peróxido paso a paso
1.
Los peróxidos son la combinación
de 2 átomos de oxígeno (se le llama bi oxígeno u oxígeno en estado caseoso) y un metal de la
primera o segunda familia. El oxígeno actúa con una valencia negativa (O-2)
Metal + O2
con valencia -1
2.
El subíndice jamás se
simplifica
1. Lo que si se puede simplificar son las valencias del metal y del oxígeno
Primero
se pone el metal después el oxigeno2
Ejemplo: K1
+ O-12
La valencia del potasio es +1 la valencia del oxígeno
es menos -1
2. Cruzamos las valencias tomando en cuenta que la valencia uno no se
escribe y el potasio (K). Igual el
Oxígeno tiene valencia uno que no se escribe.
K1+ + O-12
3. Hay que tomar en cuenta que son dos oxígenos al cruzar valencias son O2 intercambia valencia -2 que va a
la parte derecha baja del potasio ósea K-2 y la valencia del potasio que es de +1 va al
oxigeno O+1 queda entonces así: K-2
O+2 porque tenemos dos oxígenos que tienen valencia -1 multiplicamos la valencia por el número de oxígenos 2 O x 1=2 .
de modo que los dos oxígenos (O-2) pasan al K, se simplifican
las valencia y da uno que no se escribe, pero sigue quedando el número de la
cantidad de oxígenos que hay que es 2. Entonces la fórmula queda:
4. KO2
5. El nombre es
2
6. En otro ejemplo con el Calcio (Ca) cuya
valencia es 2+ ósea Ca2+ + (O2-)2 que va dentro de paréntesis
Ca2+ + (O2-)2 entonces
la valencia 2+ del calcio va al oxígeno y la valencia del Oxigeno 2- va al calcio y queda Ca2-(O2+)
2 simplificamos
Ca1- + (O2+)2 ---------> simplificar con el 2 que
esta fuera del paréntesis.
simplificar con el 2 que
esta fuera del paréntesis.
Otro ejemplo: Li1+ +
(O2)2- ------à la valencia del litio va al oxigeno O1+ y la del oxígeno va al litio Li2- ----------àLi2O2 (estos dos oxígenos no se pueden simplificar)
NOMENCLATURA
EVALUACIÓN
Realice
los ejercicios de la pagina 120 del texto-
BIBLIOGRAFIA: Texto de Química
WEBFOGRAFÍA




Comentarios
Publicar un comentario